Ученые утверждают, что разработали новый тип антибиотиков для борьбы с бактериями, устойчивыми к большинству современных антибиотиков и убивают большой процент людей с инвазивной инфекцией, пишет CNN.
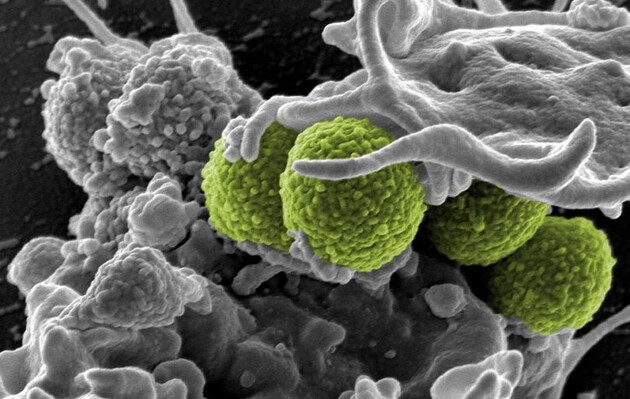
Согласно данным Центра по контролю и профилактике заболеваний США, бактерия Acinetobacter baumannii может вызвать серьезные инфекции в легких, мочевыводящих путях и крови. Она устойчива к классу антибиотиков широкого спектра действия, которые называются карбапенемами.
В 2017 году Acinetobacter baumannii, также известный как CRAB, был первым в списке Всемирной организации здравоохранения устойчивых к антибиотикам патогенов. В тот год в Соединенных Штатах бактерии повлекли примерно 8500 инфекций у госпитализированных пациентов и 700 смертей.
На CRAB приходится около 2% инфекций, обнаруженных в больницах США. Он более распространен в Азии и Ближнем Востоке и вызывает до 20% инфекций в отделениях интенсивной терапии во всем мире.
Бактерии распространены в таких заведениях, как больницы и дома престарелых. Люди с высоким риском инфицирования – это те, кто имеет катетер, кто находится на аппарате искусственной вентиляции легких или кто имеет открытые раны после операции.
Патоген настолько трудно устранить, что Управление по контролю за продуктами и лекарствами США более 50 лет не одобряло новый класс антибиотиков для его лечения, отмечают авторы в исследовании, опубликованном в среду в журнале Nature.
Однако исследователи из Гарвардского университета и швейцарской медицинской компании Hoffmann-La Roche утверждают, что новый антибиотик, зосурабалпин, может эффективно убивать Acinetobacter baumannii.
Зосурабалпин относится к собственному химическому классу и имеет уникальный метод действия. Это новый подход как относительно самого соединения, так и механизма, с помощью которого оно убивает бактерии», — убеждает доктор Кеннет Брэдли, один из исследователей, руководитель глобального отдела выявления инфекционных заболеваний Roche Pharma Research and Early Development.
Acinetobacter baumannii является грамотрицательной бактерией, то есть она защищена внутренней и наружной мембранами, что затрудняет лечение. Целью исследования было идентифицировать и настроить молекулу, которая могла бы пересекать двойные мембраны и убивать бактерии.
«Две мембраны создают очень мощный барьер для проникновения молекул, таких как антибиотики», — сказал Брэдли.
Исследователи приступили к разработке зосурабалпина, изучив около 45 тысяч небольших молекул антибиотиков, которые называются привязанными макроциклическими пептидами, и обнаружив те из них, которые могут подавлять рост различных типов бактерий. После многих лет улучшения эффективности и безопасности меньшего количества соединений, исследователи остановились на одной модифицированной молекуле.
Зосурабалпин угнетает рост Acinetobacter baumannii, препятствуя движению больших молекул, называемых липополисахаридами, к внешней мембране, где они необходимы для поддержания ее целостности. Это приводит к тому, что молекулы накапливаются внутри бактериальной клетки и становятся настолько токсичными, что сама клетка погибает.
По данным исследования, зосурабалпин был эффективным против более 100 протестированных клинических образцов CRAB.
По словам исследователей, антибиотик значительно снизил уровень бактерий у мышей с пневмонией, вызванной CRAB. Это также предотвратило смерть мышей с вызванным бактериями сепсисом.
«Обнаружение лекарства, направленного на вредные грамотрицательные бактерии, является давней проблемой из-за трудностей в том, чтобы молекулы пересекли мембраны бактерий, чтобы достичь целей в цитоплазме. Успешные соединения обычно должны иметь определенную комбинацию химических характеристик», – пишут исследователи.
По словам авторов исследования, зосурабалпин сейчас проходит первую фазу клинических испытаний по оценке безопасности, переносимости и фармакологии молекулы у людей.
Однако угроза общественному здоровью, связанная с резистентностью к противомикробным препаратам, остается огромной во всем мире из-за отсутствия эффективных методов лечения, считает доктор Майкл Лобриц, глобальный руководитель отдела инфекционных заболеваний Roche Pharma Research and Early Development, также принимавший участие в исследовании..
Устойчивость к антимикробным препаратам возникает, когда такие микробы, как бактерии и грибы, развиваются настолько, что способны пережить контакт с препаратами, предназначенными для их уничтожения.
Согласно опубликованному в Lancet анализу 2022 года, в 2019 году около 1,3 миллиона человек во всем мире скончались непосредственно от стойкости к антимикробным препаратам. Для сравнения, ВИЧ/СПИД и малярия в том же году повлекли 860 тысяч и 640 тысяч смертей соответственно.
За последние десятилетия был разработан ряд антибиотиков для лечения грамположительных инфекций, которые обычно менее вредны и менее устойчивы к антибиотикам, чем грамотрицательные бактерии, сказал Лобриц.
«Грамотрицательные бактерии на протяжении длительного времени накапливали резистентность ко многим антибиотикам первого ряда, которые мы предпочитаем», — сказал он, и зосурабалпин сейчас является единственным антибиотиком против опасного патогена.
Несмотря на то, что впереди дополнительные исследования, а до клинического использования зосурабалпина еще много лет, это очень многообещающая разработка, считает доктор Сесар де ла Фуэнте, президентский помощник профессора в Университете Пенсильвании.
«Я думаю, что с академической точки зрения, это увлекательно увидеть новый тип молекулы, убивающей бактерии другим способом. Нам, конечно, нужны новые нестандартные способы мышления об открытии антибиотиков, и я думаю, что это хороший тому пример», — подчеркнул он.
Единственным недостатком, отмечают исследователи, является то, что модифицированная молекула будет работать только против конкретных бактерий, для уничтожения которых она предназначена.
Однако де ла Фуэнте говорит, что сам метод модификации молекул для таргетинга на конкретные бактерии может быть лучше и для нашего общего здоровья, ведь большинство антибиотиков широкого спектра действия убивают полезные бактерии в нашем кишечнике и на нашей коже.
«На протяжении десятилетий мы были одержимы созданием или открытием антибиотиков широкого спектра убивающих все вокруг. Почему бы не попытаться создать конкретные, более целенаправленные антибиотики, направленные только на патоген, вызывающий инфекцию, а не на все другие вещи, которые могут быть полезны для нас?», – сказал он.
Чем чревато неконтролируемое назначение и употребление антибиотиков и что с этим делать, читайте в статье Аллы Котляр «Осторожно, антибиотик!».
Важно! Эта публикация основана на последних и актуальных научных исследованиях в сфере медицины и носит исключительно общеинформационный характер. Публикация не может являться основанием для установления каких-либо диагнозов. Если вы заболели или нуждаетесь в диагнозе, обратитесь к врачу!


















 Войти с помощью Google
Войти с помощью Google